un médicament anticancéreux existant ralentit considérablement sa progression

⇧ (VIDÉO) Vous pourriez également aimer ce contenu partenaire
Les chercheurs ont identifié deux molécules dont l’interaction augmente considérablement la propagation de la protéine toxique alpha-synucléine dans les neurones, une caractéristique clé de la maladie de Parkinson. Cibler l’un d’entre eux avec un médicament anticancéreux approuvé par la FDA inhiberait cette interaction, entraînant une réduction significative de la quantité de protéine alpha-synucléine. Le médicament pourrait ainsi constituer une option prometteuse pour ralentir la progression de la maladie.
Touchant près de 8,5 millions de personnes dans le monde, la maladie de Parkinson est la deuxième maladie neurodégénérative la plus répandue, après la maladie d’Alzheimer. Elle se manifeste par des troubles progressifs du mouvement (tremblements, raideurs, problèmes d’équilibre, difficultés d’élocution, etc.) ainsi que des troubles de l’humeur et des fonctions cognitives. Ces symptômes sont dus à l’accumulation excessive de protéines alpha-synucléine mal repliées dans les neurones et les cellules gliales.
Alors que l’alpha-synucléine soluble est essentielle à la communication synaptique, l’alpha-synucléine mal repliée est une forme toxique qui se propage progressivement du système nerveux entérique et périphérique au système nerveux central. Son accumulation induit une forme de mort programmée (processus appelé « parthanatos ») des neurones dopaminergiques, qui se traduit par les symptômes typiques de la maladie.
La propagation de l’alpha-synucléine pathologique est donc considérée comme un mécanisme essentiel de la pathogénicité de la maladie. Ce processus se produit grâce aux récepteurs de la surface cellulaire qui assurent à la fois sa propagation entre les neurones et son absorption par ceux-ci. Parmi ces récepteurs figure par exemple le gène d’activation lymphocytaire 3 (Lag3).
Des études antérieures ont montré que sa suppression réduit considérablement l’absorption de l’alpha-synucléine toxique par les neurones, sans pour autant l’arrêter. Cela suggère que d’autres récepteurs pourraient être partiellement impliqués dans la propagation et l’absorption de la protéine.
L’équipe de la nouvelle étude suggère qu’il pourrait s’agir de la protéine précurseur bêta-amyloïde de type 1 (Aplp1). En effet, il a notamment été montré que cette protéine se lie spécifiquement à l’alpha-synucléine pathologique et est associée à la neurodégénérescence. Cependant, son implication dans la propagation de l’alpha-synucléine était jusqu’alors inexplorée.
» Nos travaux ont précédemment démontré que Lag3 n’est pas la seule protéine de surface cellulaire qui aide les neurones à absorber l’alpha-synucléine. Nous nous sommes donc tournés vers Aplp1 dans nos expériences les plus récentes », explique dans un communiqué la co-auteure principale de la nouvelle étude, Valina Dawson, de l’université Johns Hopkins (aux États-Unis). Des chercheurs de l’Université de technologie de Nagaoka (Japon), de l’Université de Heidelberg (Allemagne), de l’Université de Pittsburgh et de l’Académie chinoise des sciences ont également participé à l’étude.
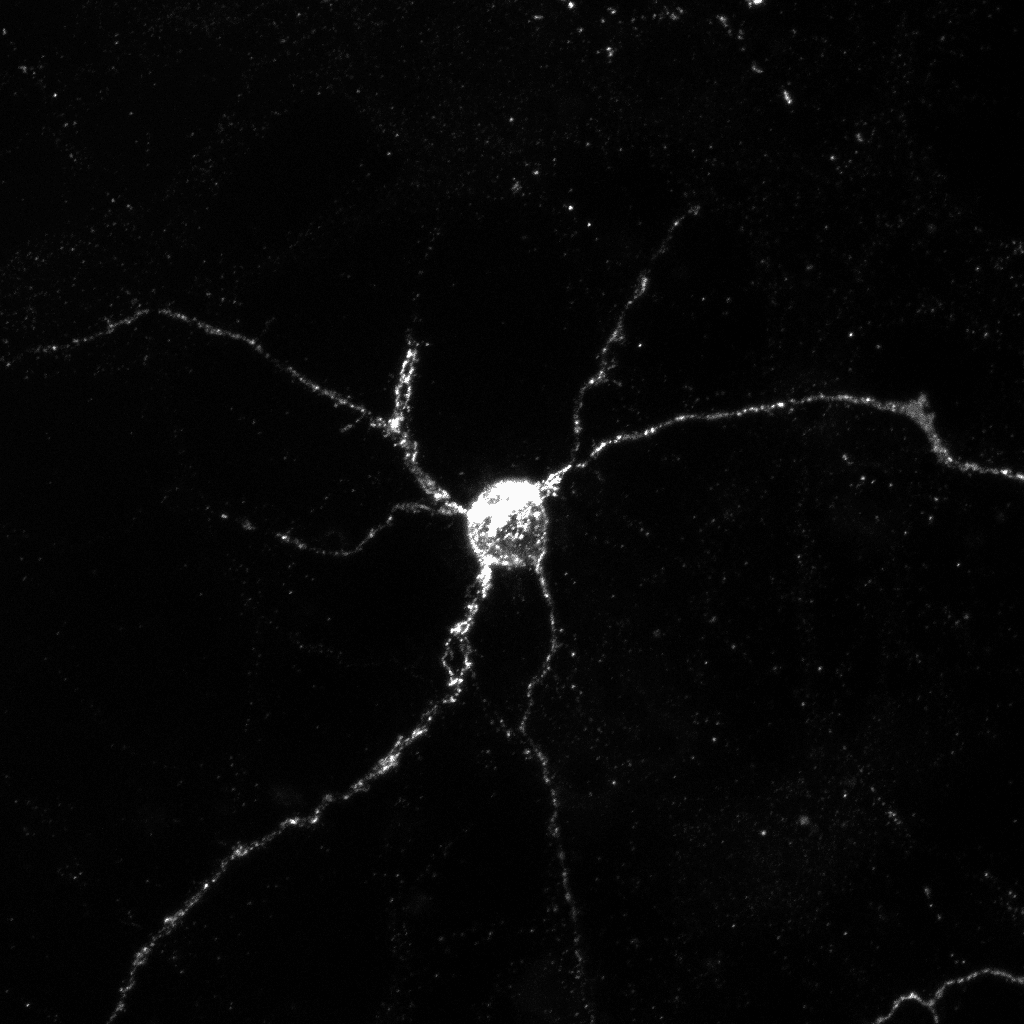
Aperçu des neurones exprimant Aplp1 (blanc), une protéine clé qui permet aux cellules cérébrales d’absorber l’alpha-synucléine, responsable de la maladie de Parkinson. © Yasuyoshi Kimura
Une réduction de 90% de l’absorption des protéines toxiques
Pour étayer leur hypothèse, les chercheurs ont sélectionné des souris transgéniques dépourvues d’Aplp1 ou de Lag3, ou des deux. Ils ont constaté que la suppression d’Aplp1 réduisait considérablement l’absorption de l’alpha-synucléine toxique et sa transmission neurone à neurone. Les déficits comportementaux ont également été réduits chez les souris dépourvues du récepteur. Un effet similaire a été observé chez les souris dépourvues de Lag3.
Cependant, l’effet était encore plus important chez les souris dépourvues des deux récepteurs. L’absorption cellulaire de la protéine nocive alpha-synucléine a chuté de 90 %, tandis que la perte de neurones dopaminergiques et les déficits comportementaux étaient presque inexistants. Cela suggère que l’interaction entre les deux protéines joue un rôle clé dans la progression de la maladie. La liaison d’Aplp1 avec Lag3 à la surface des neurones leur permettrait d’absorber massivement l’alpha-synucléine toxique circulant dans l’espace intercellulaire, ce qui conduirait au parthanatos.
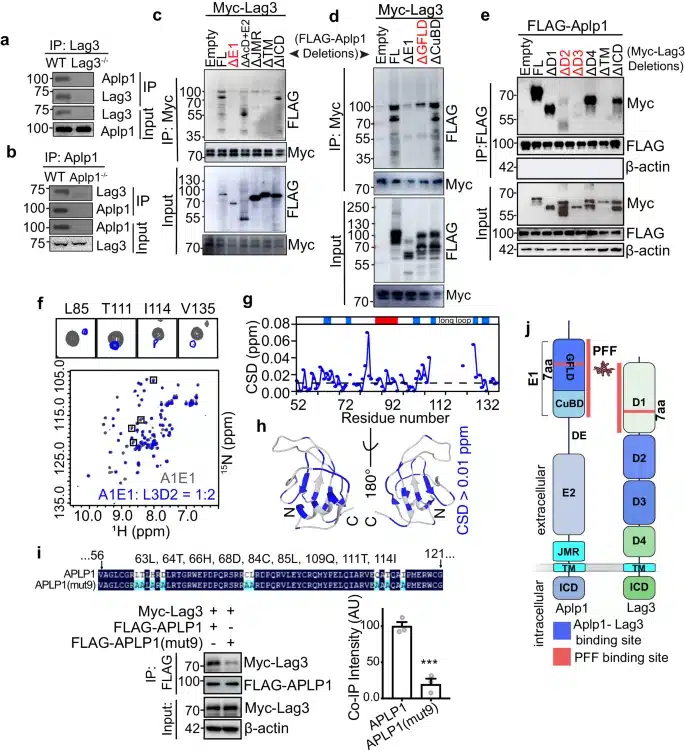

Aplp1 et Lag3 interagissent les uns avec les autres. ( a ) Lag3 inhibe Aplp1 par immunoprécipitation anti-Lag3 410C9 dans les lysats cérébraux de souris WT, mais pas dans les lysats Lag3 – / –. ( b ) Aplp1 inhibe Lag3 par immunoprécipitation anti-Aplp1 CT11 dans les lysats cérébraux de souris WT, mais pas dans les lysats Aplp1 – / –. (c, d) Cartographie des domaines de liaison Lag3 dans Aplp1. (e) Cartographie des domaines de liaison Aplp1 dans Lag3. Les expériences (a – e) ont été répétées trois fois indépendamment avec des résultats similaires. ( f – h ) Identification de l’interface de A1E1 (domaine E1 de APLP1) se liant à L3D2 (domaine D2 de LAG3). © Xiaobo Mao et al.
Un médicament qui pourrait cibler diverses maladies neurodégénératives
Les chercheurs en ont déduit que cette interaction pourrait constituer une cible potentiellement prometteuse pour traiter la maladie. Le nivolumab/relatlimab, un anticorps anti-Lag3 approuvé en 2022 par la FDA pour le traitement du mélanome, pourrait inhiber cette interaction.
Voir aussi


En injectant le médicament à des souris non génétiquement modifiées (c’est-à-dire dotées de récepteurs Aplp1 et Lag3), le médicament a efficacement inhibé la propagation et l’absorption de l’alpha-synucléine mal repliée. Cet effet était encore plus important que celui de la suppression génétique de Lag3, en raison de l’association étroite entre les deux récepteurs.
Ces résultats suggèrent que le médicament pourrait être utilisé à la fois comme traitement de la maladie de Parkinson et d’autres maladies neurodégénératives impliquant le récepteur Aplp1, comme la maladie d’Alzheimer. » Nos résultats suggèrent que cibler cette interaction avec des médicaments pourrait ralentir considérablement la progression de la maladie de Parkinson et d’autres maladies neurodégénératives. « , déclare Xiaobo Mao, co-auteur de l’étude, également de l’Université Johns Hopkins.
En revanche, étant donné que la maladie d’Alzheimer se caractérise également par l’interaction de la protéine tau avec le récepteur Lag3, il serait logiquement possible de la traiter avec le même anticorps anti-Lag3. Dans une prochaine étape, les chercheurs prévoient d’évaluer l’efficacité du nivolumab/relatlimab dans des modèles murins des deux pathologies. Les résultats de l’étude sont publiés dans la revue Communications naturelles.





